淺析生物材料寄存之專利相關規定及案例評析
淺析生物材料寄存之專利相關規定及案例評析
作者: 達穎專利師事務所 國內部 邱冠智
一、前言:
依據國內專利針對生物相關發明之審查規範,若在相關生物材料專利的申請過程,該生物材料所對應的生理、生化或者型態上的特徵,無法僅透過文字精準及詳細描述,必須藉由寄存方式,以輔助審查委員判斷專利說明書符合「充分揭露」要件;因此,本文整理國內現行專利法及專利審查基準針對生物材料寄存的適用,並引用實務判決分析以供參考。
二、生物材料寄存之相關規定
關於「生物材料」之解釋,係指含有遺傳訊息,並可自我複製或於生物系統中複製之任何物質,包括載體、微生物、動物或植物之細胞株及組織培養物、單細胞藻類。依現行專利法第27條第1項記載「申請生物材料或利用生物材料之發明專利,申請人最遲應於申請日將該生物材料寄存於專利專責機關指定之國內寄存機構。但該生物材料為所屬技術領域中具有通常知識者易於獲得時,不須寄存。」,同時參酌現行專利審查基準第二篇第十四章4.2.1章節略以記載,關於生物材料或利用生物材料之發明,已符合下列情事之一者,應提供寄存之必要:
1.該生物材料本身為申請專利之發明不可或缺之部分;
2.該生物材料亦非該發明所屬技術領域中具有通常知識者易於獲得;
3.通常無法藉說明書之文字記載而明確且充分揭露該發明,使該發明所屬技術領域中具有通常知識者可據以實現,未寄存該生物材料者,應視為不符可據以實現要件。
因此,該生物材料本身為申請專利之發明必要特徵時,申請人應先在申請專利前將該生物材料進行寄存,且生物材料之寄存日不得晚於專利申請日,而專利說明書應載明該生物材料學名、生物材料分類學特徵之相關資料及必要之基因圖譜或圖式,使該發明所屬技術領域中具有通常知識者,能瞭解該生物材料之內容,並可據以實現。
再者,寄存證明文件之檢送時機依同法第27條第2、3項指示,應於專利申請日後四個月內,或最早之優先權日後十六個月內補呈相關資訊即可。在實務上而言,專利申請人應先確保生物材料之寄存日不晚於專利申請日,所以在申請生物材料之發明專利前,先將該生物材料即早進行寄存,並盡可能在確定取得寄存證明後,再提出專利申請,據以當寄存機關於試驗過程發現生物材料有重新申請寄存之必要時,申請人能有充分之時限重新補正生物材料,以防止最後取得之寄存日晚於專利申請日之問題。
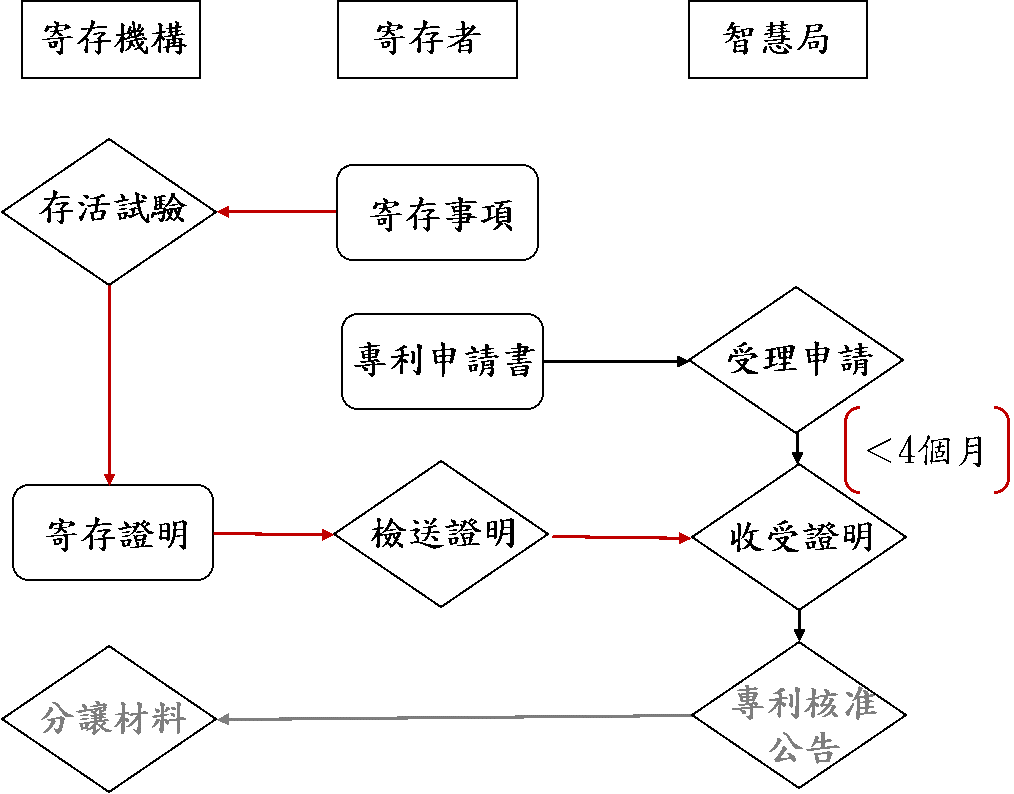
寄存程序與申請專利程序關係圖
三、生物材料寄存之但書事項
依現行專利法第27條第1項記載關於「該發明所屬技術領域中具有通常知識者易於獲得」係在申請日前已符合下列情事之一者,該生物材料即無須進行寄存:
1.商業上公眾可購得之生物材料;
2.申請前業已保存於具有公信力之寄存機構且已可自由分讓之生物材料;例如專利專責機關指定之國內寄存機構或依布達佩斯條約寄存於國際專利組織指定之專利寄存機構等,其中,臺灣之寄存機構為「財團法人食品工業發展研究所」辦理關於專利申請之生物材料寄存之業務。
3.該發明所屬技術領域中具有通常知識者根據說明書之揭露而無須過度實驗即可製得之生物材料。
評估上述第1或2項而無須寄存之情事,應考慮該生物材料是否有下列無法證明輕易獲得之事項:
(1)生物材料無法確認是否為商業上公眾可購得,得要求申請人提供如列有該生物材料之商品目錄正本或經公證之影本等相關證明文件。
(2)生物材料無法確認是否於申請前已保存於具公信力之寄存機構,得要求申請人提供如該寄存機構所發行列有該生物材料之菌種目錄。
(3)生物材料無法確認是否已於申請前可自由分讓,得要求申請人提供如該生物材料為大眾可自由分讓之證明文件。
(4)對於申請人主張申請前已依布達佩斯條約寄存於國際專利組織指定之專利寄存機構且於申請日前已公告於專利公報或已獲准專利權之生物材料,若無法確認該生物材料之公告或獲准狀態,得要求申請人提供如該生物材料於專利公報中之公告資料等相關證明文件。
(5)對於申請人主張申請前已依布達佩斯條約寄存於國際專利組織指定之專利寄存機構且於申請日前已公開於專利公報之生物材料,若無法確認該生物材料之公開狀態及是否處於可自由分讓之狀態,得要求申請人提供該生物材料於專利公報中之公開資料,以及證明該生物材料於公開後即可自由分讓之文件。
四、案例分析-行政判決(97年行專訴字第78號)
我國專利實務對於生物材料「易於獲得」有不同的見解,因此本文提出相關判決供各界參考。本判決系爭專利為申請號第090119437號「抗-雙整聯蛋白抗體,組成物,方法及用途」發明專利,該系爭專利之請求項1揭示:「一種經單離之人類抗-雙整聯蛋白抗體,其專一性結合至人類αVβ3及αVβ5整聯蛋白,其包括(i)SEQ ID NO:1、2、與3之所有重鏈互補決定區域(CDR)胺基酸序列;及(ii)SEQ ID NO:4、5、與6之所有輕鏈CDR胺基酸序列。」,且請求項2揭示:「一種經單離之人類單株抗-雙整聯蛋白抗體或其抗原結合部分,其專一性結合至人類αVβ3及αVβ5整聯蛋白,包括選自SEQ ID NO:7及8之重鏈及輕鏈可變區域。」
其中,原告主張:「系爭專利之申請案申請專利範圍第1項、第2項之技術內容觀之,所請之抗體係以胺基酸序列加以界定,而非以『特定偶合常數之親和力』予以特定,非屬『特別限制條件』。又由於所有抗體皆具有特定的胺基酸序列,才能針對個別抗原予以作用,因此該胺基酸序列不能謂為『特殊限制條件』,否則所有抗體均須寄存。」
此外,原告另主張:「系爭專利在世界各國申請中或已獲准專利之對應案,均未聞有任何國家之專利主管機關或認定系爭專利生物材料應寄存,亦證被告對於本件生物材料是否為『所屬技術領域中具有通常知識者易於獲得』之事實認定有誤…」原告認為國內基因工程科技水準已得與世界先進國家並駕齊驅,認為系爭專利所載「生物材料」已符合申請時專利法第30條第1項(如現行專利法第27條參照)「該生物材料為所屬技術領域中具有通常知識者易於獲得」之但書事項。
然法院認為:系爭專利所請之單株抗體,其篩選工作繁複困難,必須經由過度實驗始可製得,因此,熟習該項技術者僅依系爭專利申請之專利說明書之揭露,根本無法易於獲得而據以實施該發明,藉以法院認定系爭專利所請之生物材料並非所屬技術領域中具有通常知識者易於獲得者,故原告應適用申請時專利法第30條第1項(如現行專利法第27條參照)「申請人最遲應於申請日將製造系爭專利之生物材料予以寄存,並於申請書上載明寄存機構、寄存日期及寄存號碼」之事項;然原告不僅未予寄存,且系爭專利之專利說明書不符「充分說明而可據以實施」之要件,因而違反申請時專利法第30條第1項及第26條第2項規定;另外,至於原告所舉系爭專利之其他國家專利對應案均無須寄存生物材料之例,經核各國法制互異,尚難比附援引執為系爭專利亦無須寄存生物材料之有利論據,故最終法院判決,原告之訴駁回。
五、結論:
本文所載之事項提供專利申請人作為申請生物材料之發明的參考及依據。在申請生物相關發明專利時,尤其該發明為生物材料或利用生物材料之標的,申請人應考量該生物材料是否符合寄存之事項,若該生物材料為寄存之必要者,申請人於提出專利申請前,應先向寄存機構(食品工業發展研究所)提出專利生物材料寄存申請,盡可在專利申請前提前取得寄存證明,並於專利申請日或補正期間內檢送寄存證明文件,據此,審查委員於審查專利說明書時,得參酌申請人所寄存之生物材料的特徵,使該專利說明書所揭露之生物材料符合充分揭露之要件。
參考文獻:
現行專利法第26條之規定
現行專利法第27條之規定
現行專利審查基準第二篇第十四章4.2「生物材料寄存」之章節
民國102年版專利生物材料寄存-說明手冊
智慧財產法院97年行專訴字第78號行政判決



